产蛋后期蛋壳质量差?根源或在子宫的钙转运机制!
时间:2025-09-04
来源:蛋鸡营养荟
蛋壳破损是蛋品行业的主要经济损失来源之一。蛋壳破碎强度是衡量其抵抗外力能力的关键指标,它随着母鸡日龄增长而下降。蛋壳主要由碳酸钙和少量有机基质构成,其在子宫内的形成过程可分为起始、快速沉积和终止三个阶段。此过程需要大量钙离子从血液转运至子宫,依赖于多种转运蛋白(如:TRPV6、CALB1、ATP2A3)的精密协作。
此前研究发现,高产蛋品质与这些蛋白的高表达有关。代谢组学则为了解子宫内的微环境提供了新视角,表明一些小分子代谢物也参与调控钙化。然而,关于不同强度蛋壳在钙化各阶段子宫内的具体代谢差异,我们仍知之甚少。
《家禽科学》杂志近期发表的一项研究,选取200只75周龄海兰褐产蛋鸡,按其蛋壳破碎强度分为高强度组(HS组,>42 N)和低强度组(LS组,<32 N),通过比较两组在蛋壳钙化阶段子宫组织中钙转运相关蛋白及代谢物的差异,系统解析了蛋壳品质下降的潜在生理机制。
研究结果显示,低强度组蛋壳品质显著下降。蛋壳物理性能检测清晰表明,低强度组(LS)蛋壳在多个关键指标上均显著劣于高强度组(HS)。具体来看,其蛋壳厚度比高强度组低了约7.7%,蛋壳重量轻了约11.8%,蛋壳比率(占蛋重百分比)低了约11.0%,而其蛋壳破碎强度更是大幅下降了约36.5%。不过,两组的蛋重、蛋形指数及断裂韧性等指标则无明显区别。
虽然蛋壳中的钙、磷百分比含量两组相当,但由于低强度组蛋壳整体质量更轻,导致其单个蛋壳的总钙沉积量显著减少了约19.8%,总磷量也降低了约12.7%。表明其矿化程度的不足。
在随后的电镜观察中发现,低强度组蛋壳的钙化总厚度和栅栏层有效厚度均明显变薄,有效层占比也更低,提示蛋壳超微结构存在缺陷。这些结构上的缺陷是导致其机械强度下降的直接原因。然而,构成蛋壳基础的乳突层结构无差异,说明问题可能主要出在钙化加速期。
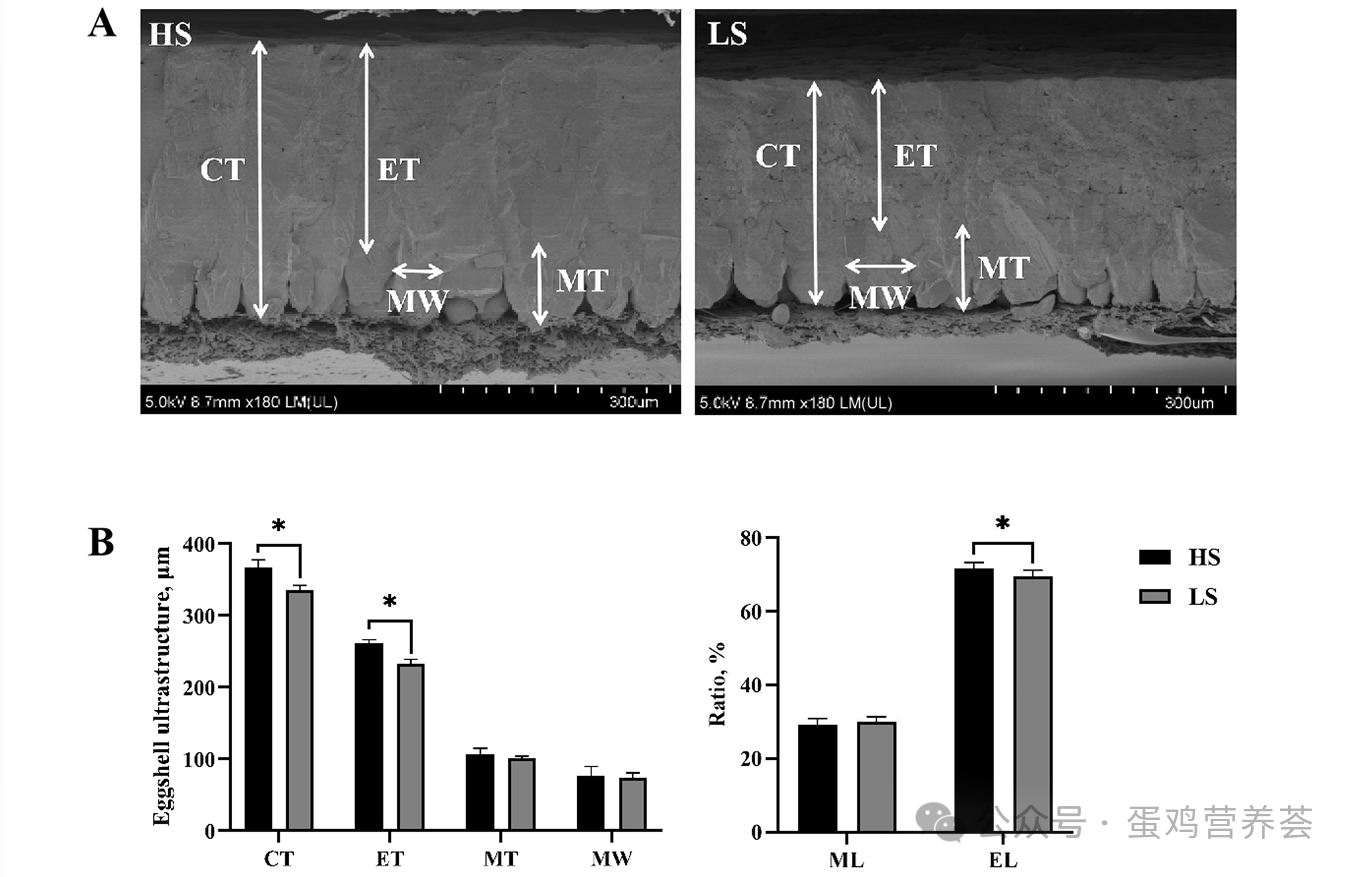
产蛋后期LS组与HS组的蛋壳超微结构。HS表示高蛋壳强度组,LS表示低蛋壳强度组。CT:钙化厚度;ET:有效厚度;MT:乳突层厚度;MW:乳突结节宽度;ML:乳突层厚度比例;EL:有效层厚度比例。结果以平均值±标准误(SEM)表示,n=10。星号(*)表示组间差异显著(P < 0.05)
同时研究者也发现,子宫钙代谢与转运效率出现异常。对钙代谢动态的监测发现,在蛋壳钙化刚刚启动的产蛋后7小时,低强度组子宫粘膜中的钙离子浓度明显低于高强度组,提示其初始钙供应或捕获能力可能不足。
在分子机制层面,低强度组在钙化启动期(7h)呈现TRPV6蛋白(钙摄入)异常升高而CALB1蛋白(胞内钙转运)显著降低的表达模式,提示子宫细胞可能存在钙处理效率低下。基因表达层面,关键钙转运基因(如ATP2A3、ATP2B2)在低强度组未能如高强度组在快速钙化期(17h)有效上调,导致钙转运活性持续低迷。
代谢组学分析揭示了更深层次的代谢差异。在钙化起始阶段(7h),高强度组子宫内抗氧化物质(如谷胱甘肽、瓜氨酸)水平较高,有利于维持稳态;LS组则出现核苷酸类物质(如脱氧鸟苷、腺苷)积累,提示细胞可能处于修复状态,子宫内代谢环境失衡。
到了钙化快速沉积期(17h),高强度组TCA循环代谢物(α-酮戊二酸、富马酸)显著上升,能量供应充足;而低强度组仍未能有效启动产能代谢,反而出现氧化应激相关物质(鞘氨醇、氧化型谷胱甘肽)升高,显示组织健康与钙沉积能力受损。
总之,子宫在蛋壳钙化不同阶段扮演着动态变化的角色:起始期重在维持氧化还原稳态,为成形做准备;生长期则强效转运钙离子,依赖充沛能量。老龄蛋鸡蛋壳强度降低,可归因于起始阶段钙水平不足与生长阶段氧化还原失衡,共同削弱了钙转运与沉积效率。
1、凡注明为其它媒体来源的信息,均为转载自其它媒体,转载并不代表本网赞同其观点,也不代表本网对其真实性负责。
2、您若对该内容有疑问,请即与本网联系,本网将迅速给您回应并做处理。
3、本网站将尽力保证服务的及时性、客观性,但不保证服务一定能满足用户的要求,也不保证服务不会受中断。本网站所提供的所有信息和数据服务仅限于用户参考,不对用户的商业运作做任何具体性指导。用户因参考本网站提供的信息所带来的一切风险及法律后果由用户自行承担。