影响鸡传染性支气管炎诊断的因素
时间:2024-10-14
来源:鸡保姆
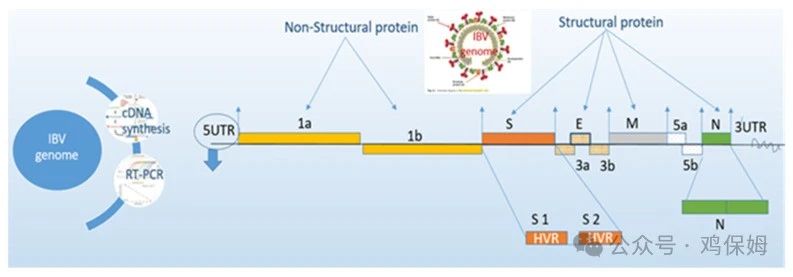
很少有方法可用于传染性支气管炎 (IB) 诊断,以识别当前感染中的病毒或病毒感染后的特异性抗体反应。由于多种因素的影响,选择成功检测鸡传染性支气管炎病毒(IBV)的最佳检测方法是困难且令人困惑的,如下所述。
1.临床体征
IBV 的临床症状与其他呼吸道感染相似,但有一些独特的病变是毒株变异的一部分,难以与其他呼吸道病毒感染区分开来。尽管临床症状根据图谱进行匹配,但血清学研究从未根据解剖病变进行匹配。
血清学滴度偶尔有升高趋势,但与临床症状不符;因此,IBV确认是有问题的。因此,构象诊断是基于农场记录中数据的积累,包括鸡蛋质量和产量曲线、死亡率、血清转化或抗体水平、疫苗接种报告和血液血清学,这些是通过PM病变同时匹配IBV鸡的症状的临床体征。 IBV 分离的样本采集最好立即进行,因为临床症状很明显。逆转录 RNA 的 PCR 是检测活动性感染中 IBV 的有效方法。一些研究表明,营养缺乏是检测 IBV 的一个重要考虑因素。
2.疫苗接种
疫苗接种是IBV鉴定的主要影响因素,因为它需要感染的IBV疫苗株和其他强毒株。对于未接种疫苗的鸡群,可以通过 RT-PCR、RT-qPCR 或几周后的阳性 IBV 滴度简单地检测到现场攻击。因此,由于血液中的抗体循环,在已接种疫苗的鸡群中识别现场挑战或主动感染非常困难。如今,疫苗株可以通过使用灭活油乳剂疫苗的区分感染者与接种动物(DIVA)技术来区分疫苗株与现场毒株,该技术可以通过简单的中和试验、酶联免疫吸附测定(ELISA)和间接免疫荧光试验进行检测。
3.检测选择
诊断技术的选择对于与样本采集和采样数量相关的正确诊断非常重要。先进的 ELISA 测试可以区分疫苗接种产生的抗体和感染产生的抗体。
感染后2-4周后抗体滴度浓度趋于异常升高;在随后的几周内滴度逐渐缓慢下降。随后,下一次血样应在2周后采集,但不得晚于4周,在同一受感染的房屋中采集,因为由于免疫系统需要时间来建立免疫力,因此滴度延迟到最高水平。
感染后3-5天内,受感染组织中病毒浓度最高;需要选择分子测定和病毒分离来代替血清学监测。目前,常见的分子方法已应用于 IBV 诊断,特别是 RT-PCR,但IBV分离更具挑战性、耗时,并且只能从受感染的鸡中分离,因为需要在含胚鸡蛋中进行多次传代,直到病毒复制。或者,由于引物结合位点频繁发生突变,各种类型的变体可能会逃避识别,因此需要经常更新引物以应用于分子测定。
4.血清学
平均滴度提供了接种疫苗后鸡群内受测禽类抗体反应的信息。平均滴度应达到可预测的范围,正常鸡群的平均滴度分布均匀,患病鸡群的滴度无意中更高。
一项研究表明,疫苗免疫的抗体模式不应因现场感染而被破坏。感染后,当滴度水平比疫苗接种后预期水平高至少2倍或感染前平均滴度水平至少 2 倍时,几何平均滴度(GMT)应异常增加。有时,接种疫苗后平均滴度会逐渐升高;然而,正常生产时未发现任何临床症状,表明疫苗具有良好的保护作用和更好的反应。
根据一般参数,灭活疫苗接种后变异百分比系数(CV)保持在40%以下,活疫苗接种后保持在60%以下,表明疫苗接种均匀性良好。当CV小于20%时,滴度水平表现出良好的均匀性,但指定了以前的疾病暴露或良好的疫苗接种。因此,有必要与死亡率、临床体征和生产记录进行交叉比对,以最终确认IBV。对CV百分比的良好评估显着低于疫苗接种后的预期水平或显着低于早期感染病例的水平。因此,单次注射 IBV 活疫苗后CV%低于30% 则被指定为可疑挑战。相反,在接种高免疫原性 IBV 变种疫苗后,CV百分比通常低于45%。在这种情况下,在接种灭疫苗之前,首先使用一系列多重活疫苗接种来促进禽类100%血清转化,这是影响滴度持久性而不是CV百分比测量的主要原则。
5.器官选择和样本质量
上呼吸道(UTI)是IBV复制的主要部位;随后,病毒血症导致病毒增殖并通过血液循环传播到其他组织 。由于受感染或免疫鸡群的持续交叉感染,IBV可在盲肠扁桃体和肾脏中长期持续存在。在急性病例中,临床症状是在呼吸道中发现的,这是汇集样本的首选地点。此外,在产蛋阶段接种疫苗的鸡的慢性感染中选择了肾脏、盲肠扁桃体和泄殖腔样本,而在呼吸道中可以预测到少量病毒。收集器官应更快地冷藏,以保留病毒活力以进行进一步的分子诊断。如果没有冷冻或冷藏设施,样品应在 50% 甘油中保存几天。
6.感染期间的免疫和挑战
血清学监测可以直接帮助评估禽类的免疫状态、病毒攻击和病毒感染持续时间。不同类型的商业 ELISA 试剂盒使用不同的截止值和数学公式来计算以转换 ELISA 结果。农业中增强免疫力以控制 IBV 感染的最常见做法是先接种减毒活疫苗,然后接种具有正常滴度水平的灭活疫苗,以提供良好的 IBV 保护。
IBV 攻击通常会在感染后 6-8 周后检查异常高的 IBV 滴度时显示呼吸道症状。对于种鸡,计算受攻击鸡的正常指导是感染后的平均滴度至少是疫苗接种滴度(基线)预期的 2 或 3 倍,如图所示图A、B 。对于肉鸡,攻击中通常会显示异常的 IBV 滴度,而在活疫苗接种与正常血清学相关后,感染后的平均滴度应超过 3-4 K (Idexx 标准),如图分别为C、D。
在 ELISA 检测中,应根据疫苗接种计划、IBV 的地理分布、爆发历史、特定疫苗和检查的禽类类型,通过预期的疫苗接种滴度来确定诊断。这些各自的因素与定期鸡群报告的组合相关,以确定血清学结果是正常还是异常。许多因素影响抗体水平,特别是病毒株,以及与鸡有关的一些因素(例如,品种、类型、年龄、免疫状态和营养)、疫苗(例如,减毒水平、剂量、活的或死的)疫苗,和储存条件)和疫苗接种时间表(例如,正确的时间表、准备和给药途径)。
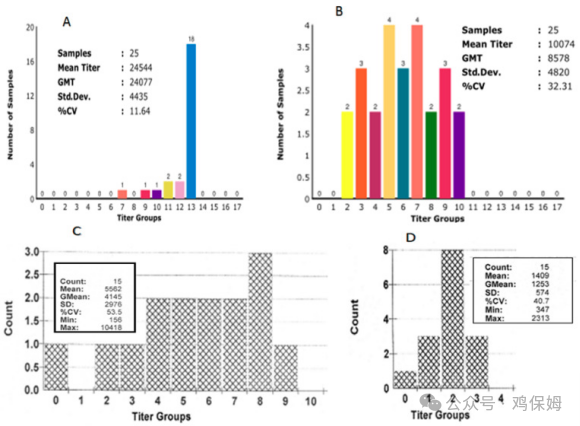
图2 比较两个肉种鸡舍中 ( A ) 攻击鸡群和 ( B ) 正常鸡群 26 周时的 IBV 血清学分析。计算出受攻击鸡群的平均滴度是正常鸡群的三倍,并且与之前使用美国Symbiotic检测试剂盒进行的血清学检测相比,变异系数(CV%)太低。产蛋高峰期 IBV 感染后的高挑战滴度几乎位于单个条形中。在肉鸡中,( C ) 在 35 日龄观察到的 IBV 感染后高攻击滴度超过 3-4 K 滴度,计算为 IBV 感染后,与 ( D ) 正常血清学相比,基于美国 Idexx ELISA 检测试剂盒的标准。
7.遗传学和免疫抑制
遗传性状对IBV的抵抗力和易感性影响很大。一些实验研究表明,IBV 免疫后不同育种品系中发现了不同的遗传性状、死亡率、病毒生长和可变的组织病理学。但由于鸡系间的易感性存在差异,不同的检测方法存在一定的差异。一些免疫抑制感染与 IBV 疾病的恶化有关,例如传染性法氏囊病 (IBD)、马立克氏病 (MD)、包涵体肝炎 (IBH) 和鸡传染性贫血 (CIA) 可能会抑制幼年时的免疫状态,这可以通过刺激法氏囊和胸腺中的淋巴细胞耗竭来扰乱 IBV 的获得性疫苗免疫,从而导致对攻击的更高抵抗力。主要损害受到亚临床感染的影响,因此很难理解免疫抑制剂。
用于确认 IBV 感染的实验室诊断方法涉及其他呼吸道病毒,这些病毒需要连续的血清学监测来确定当前感染的实际来源。同样,环孢素被归类为T细胞免疫抑制药物,可显着降低禽类的免疫力,并且在IBV感染中受到高度刺激。
来源:鸡保姆,作者:Md. Safiul Alam
1、凡注明为其它媒体来源的信息,均为转载自其它媒体,转载并不代表本网赞同其观点,也不代表本网对其真实性负责。
2、您若对该内容有疑问,请即与本网联系,本网将迅速给您回应并做处理。
3、本网站将尽力保证服务的及时性、客观性,但不保证服务一定能满足用户的要求,也不保证服务不会受中断。本网站所提供的所有信息和数据服务仅限于用户参考,不对用户的商业运作做任何具体性指导。用户因参考本网站提供的信息所带来的一切风险及法律后果由用户自行承担。